ORBITALES ATOMICOS
La distribución de un electrón en un átomo se describe mediante una función de onda conocida como orbital atómico.
La distribución de un electrón en un átomo se describe mediante una función de onda conocida como orbital atómico.
Las funciones de onda de los electrones en los átomos se denominan orbitales atómicos. El nombre se eligió para sugerir algo menos definido que una "órbita" de un electrón alrededor de un núcleo y para tener en cuenta la naturaleza ondulatoria del electrón. Las expresiones matemáticas de los orbitales atómicos -que se obtienen como soluciones de la ecuación de Schrödinger- son complicadas.
NO hay que perder de vista su interpretación: el cuadrado de una función de onda te dice la densidad de probabilidad de un electrón en cada punto. Para visualizar esta densidad de probabilidad, imagine una nube centrada en el núcleo. La densidad de la nube en cada punto representa la probabilidad de encontrar un electrón allí. Las regiones más densas de la nube representan los lugares donde es más probable que se encuentre el electrón es más probable que se encuentre el electrón.

Cuando se resuelve la ecuación de Schrödinger para un átomo tridimensional, resulta que tres números cuánticos son necesarios para etiquetar cada función de onda. Los tres números cuánticos se denominan n, l y ml:
· n está relacionado con el tamaño y la energía del orbital.
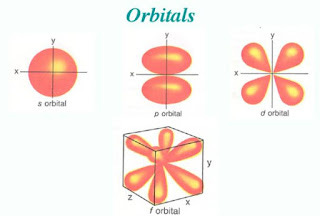
· l está relacionado con su forma.
· ml está relacionado con su orientación en el espacio.
El número cuántico principal, especifica la energía del orbital en un átomo de un electrón. En un átomo de un solo electrón, todos los orbitales atómicos con el mismo valor del número cuántico principal n tienen la misma energía y se dice que pertenecen al mismo nivel del átomo. Este nombre refleja el hecho de que a medida que n aumenta, la región de mayor densidad de probabilidad es como una cáscara casi hueca de radio creciente. La distancia media de un electrón al núcleo aumenta con el valor de n.
El segundo número cuántico necesario para especificar un orbital es l, el número cuántico del momento angular del orbital. Este número cuántico puede tomar los valores de:
l = 0, 1, 2, ……, n - 1
Hay n valores diferentes de l para un valor dado de n. Por ejemplo, cuando n= 3, l puede tener cualquiera de los tres valores 0, 1 y 2. Los orbitales de un nivel con número cuántico principal n se dividen, por tanto, en n subniveles, grupos de orbitales que tienen el mismo valor de l. Sólo hay un subnivel en el nivel n = 1 (l = 0), dos en el nivel n = 2 (l = 0 y 1), tres en el nivel n = 3 (l = 0, 1 y 2), y así sucesivamente. Todos los orbitales con l= 0 se llaman orbitales s, los que tienen l = 1 se llaman orbitales p, los que tienen l = 2 se llaman orbitales d, y los con l = 3 se llaman orbitales f.
El tercer número cuántico necesario para especificar un orbital es ml, el número cuántico magnético que distingue los orbitales individuales dentro de un subnivel. Este número cuántico puede tomar los valores
ml = -l,…0,…+l
Hay 2l - 1 valores diferentes de ml para un valor dado de l y, por tanto, 2l - 1 orbitales en un subnivel de número cuántico l. Por ejemplo, para un orbital p, l = 1 y ml = -1,0,+1; por lo que hay tres orbitales p en un subnivel dado. Alternativamente, un subnivel con l = 1 puede decirse que consta de tres orbitales. Los orbitales con el mismo valor de l pero diferentes valores de ml son degenerados incluso en átomos de muchos electrones. Así, los tres orbitales p son degenerados tanto en el hidrógeno como en los átomos de muchos electrones.
CONCLUSION: Los orbitales atómicos se designan con los números cuánticos n, l y ml y se dividen en niveles y subniveles.