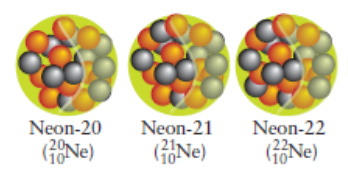
En la ciencia, una nueva y más precisa técnica de medición puede conducir a un gran descubrimiento. Cuando los científicos utilizaron por primera vez los espectrómetros de masas, descubrieron -para su asombro que no todos los átomos de un mismo elemento tienen la misma masa, por lo que el modelo de Dalton no es del todo correcto. En una muestra de neón perfectamente puro, por ejemplo, la mayoría de los átomos tienen masa 3,32 x 10-26 kg, que es aproximadamente 20 veces mayor que la masa de un átomo de hidrógeno. Sin embargo, algunos átomos de neón resultan ser unas 22 veces más pesados que el hidrógeno. Otros son unas 21 veces más pesados .
Los tres tipos de átomos tienen el mismo número atómico (z = 10), por lo que definitivamente son átomos de neón, pero contrariamente a la opinión de Dalton, no son idénticos. La observación de que los átomos de un mismo elemento pueden tener masas diferentes ayudó a los científicos a refinar aún más el modelo nuclear. Se dieron cuenta de que un núcleo atómico debe contener partículas subatómicas además de protones y propusieron que también contiene partículas eléctricamente neutras llamadas neutrones (denominadas n). Como los neutrones no tienen carga eléctrica, su presencia no afecta a la carga nuclear ni al número de electrones del átomo. Sin embargo, tienen aproximadamente la misma masa que los protones, por lo que aumentan considerablemente la masa del átomo. Por lo tanto, un número diferente de neutrones en un núcleo da lugar a átomos de diferentes masas diferentes, aunque los átomos sean del mismo elemento. Aparte de su carga, los neutrones y los protones son muy similares; se conocen conjuntamente como nucleones .
El número total de protones y neutrones de un núcleo se denomina número de masa , A , del átomo. Un núcleo de número de masa A es aproximadamente A veces más pesado que un átomo de hidrógeno, que tiene un núcleo formado por un solo protón. Por lo tanto, si se sabe que un átomo es un cierto número de veces más pesado que un átomo de hidrógeno, se puede deducir el número de masa del átomo. Por ejemplo, como la espectrometría de masas muestra que las tres variedades de átomos de neón de neón son 20, 21 y 22 veces más pesadas que un átomo de hidrógeno, se sabe que los números de masa de los tres tipos de átomos de neón son 20, 21 y 22. Porque para cada uno de ellos Z =10 estos átomos de neón deben contener 10, 11 y 12 neutrones, respectivamente .
Un átomo con un número atómico y un número de masa determinados se denomina nucleido (Nucleido es el nombre genérico que se aplica a todos los átomos que poseen el mismo número atómico y el mismo número másico) . Así, oxígeno-16 ( Z = 8, A = 16) es un nucleido y el neón-20 ( Z = 10, A = 20) es otro. Los átomos con el mismo número atómico (es decir, átomos del mismo elemento) pero con números de masa diferentes se llaman isótopos. Todos los isótopos de un elemento tienen exactamente el mismo número atómico, por lo que tienen el mismo número de protones y electrones pero diferente número de neutrones. Un isótopo se nombra escribiendo su número de masa después del nombre del elemento, como en neón-20, neón-21 y neón-22. Su símbolo se obtiene escribiendo el número de masa como superíndice a la izquierda del símbolo químico del elemento, como en 20 Ne, 21 Ne y 22 Ne. (ver figura). En ocasiones se puede ver el número atómico incluido como subíndice en la parte inferior izquierda, como en el símbolo 10 22Ne utilizado en la figura.
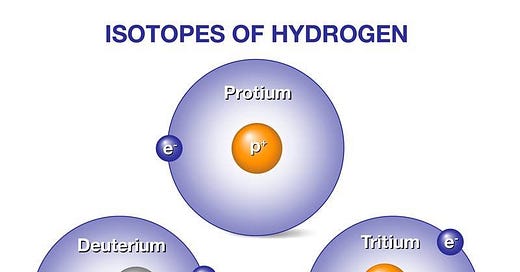
El hidrógeno tiene tres isótopos ( ver tabla ). El más común ( 1 H) no tiene neutrones; su núcleo es un protón solitario. Los otros dos isótopos son menos comunes, pero son tan importantes en química y física nuclear que reciben nombres y símbolos especiales. El isótopo con un neutrón (2 H) se llama deuterio (D), y el que tiene dos neutrones (3 H) se se llama tritio (T).