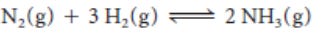Algunas reacciones, como la reacción explosiva del hidrógeno y el oxígeno, parecen proceder hasta su finalización, pero otras parecen detenerse en una fase temprana. Por ejemplo, consideremos la reacción que tiene lugar cuando el nitrógeno y el hidrógeno se calientan a presión en presencia de una pequeña cantidad de hierro:
La reacción produce amoníaco rápidamente al principio, pero finalmente la reacción parece detenerse Como muestra el gráfico (ver arriba), no importa el tiempo que se espere, no se forma ningún producto adicional. Lo que realmente ocurre cuando la formación de amoníaco parece detenerse es que la velocidad de la reacción inversa:
aumenta a medida que se forma más amoníaco. La reacción alcanza el equilibrio cuando el amoníaco se descompone tan rápido como se forma. Este estado de equilibrio dinámico se expresa sustituyendo la flecha de la ecuación química por "arpones" de equilibrio:
Todos los equilibrios químicos son dinámicos. Los equilibrios dinámicos son equilibrios vivos en el sentido de que responden a los cambios de temperatura, presión y a la adición o eliminación de incluso una pequeña cantidad de reactivo. Una reacción que simplemente no tiene lugar (como la de una mezcla de hidrógeno y oxígeno a temperatura y presión ambiente) tiene una composición que no responde a pequeños cambios en las condiciones.